2023年8月15日,国家药典委员会官网发布“关于征求《中国药典》9个金属类药包材通则意见的函”,拟对2025年版《中国药典》新增收入的5400《药品包装用金属组件和容器》进行征求意见,公示期自发布之日起1个月。这是根据中国药典2025版药包材标准体系的整体规划和编制思路。此通则规定了药品包装系统用金属组件和容器研发、生产、使用、质量控制时应当符合的基本要求,中邦咨询对5400《药品包装用金属组件和容器》要点进行了整理,供大家参考。

一、了解药品包装材料——金属包装相关术语
1. 药品包装材料
简称药包材,是指直接接触药品的包装材料和容器,它可保护药品免受环境影响并保持药品的原有属性。药包材是药物制剂的重要组成部分,合格的药包材是保证药物制剂发挥其疗效的前提。按材料组成分类,常见的药包材主要有六大类品种包装:塑料包装、玻璃包装、橡胶包装、金属包装、预灌封包装以及其他包装。
2. 药品包装用金属材料
在正常使用条件下,预期或已经应用于药品包装的各种金属(包含各种金属镀层及合金以及配合使用的金属)材料。
3. 药品包装用金属组件
在正常使用条件下,预期或已经应用于药品包装的各种金属(包含各种金属镀层及合金)材料经锻造、拉伸、压延等工艺等制成的一定形式的金属包装组件。
4. 药品包装用金属容器
在正常使用条件下,预期或已经应用于药品包装的各种金属(包含各种金属镀层及合金)材料制成的容器。
二、药品包装用金属组件和容器质量控制要求有哪些?
金属组件与容器应按照质量风险控制等要求,选择适当的质量要求项目,制定产品的企业标准或质量协议,并根据生产和使用的风险管理要求制定检验规则。在生产和使用过程中,应根据特定制剂的需求,包括但不限于本通则的规定,在品类通则项下选用适宜的项目进行检查。对于与安全直接或间接相关的检查项目,一般应采用限度指标加以控制,质量控制项目如下:
1. 鉴别
所用金属基材和镀层等材料成分应与产品所定义或标识成分、牌号的相应成分一致,按照供需双方确认的检验频率,金属基材按照金属材料元素含量测定法(通则4250),成分和/或杂质含量应符合企业标准或质量协议相关规定。通过原料成分的限制要求,明确原料生产供应商在供应链中的责任和义务,包括原材料质量控制和信息传递的责任和义务。
2. 理化性能
对金属类材料的关键质量属性,按照剂型的风险程度结合产品特点,建立相关限度指标。金属容器类包装:取完整样品适量,按照药包材溶出物测定法(通则4204) 采用浸提介质水、4%乙酸、50%乙醇灌装至标示容量70℃±2℃保持24h,采用浸提介质正己烷灌装至标示容量58℃±2℃保持24h,药品包装用金属组件和容器溶出物制备详见表1。
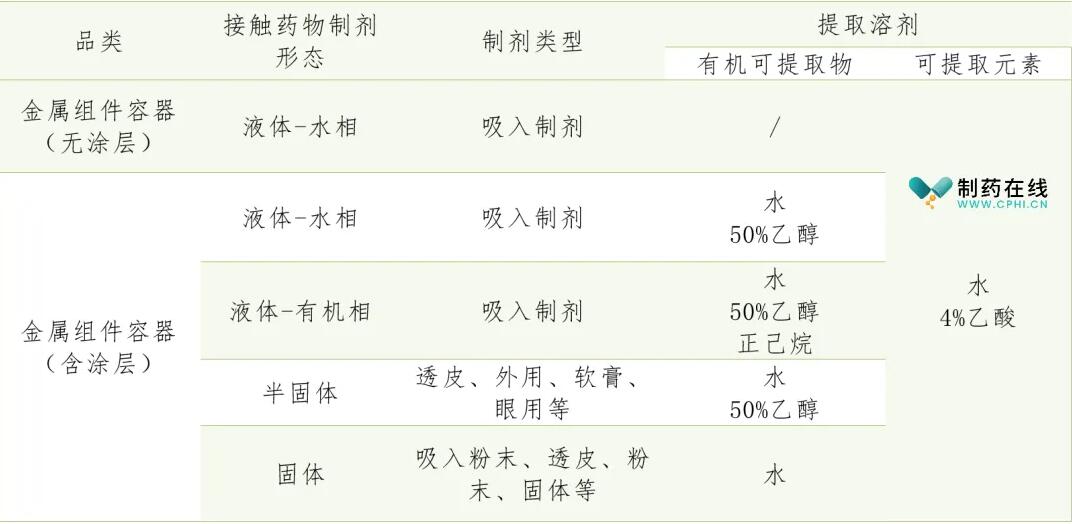
照药包材溶出物测定法(通则4204) 测定以下项目。
2.1易氧化物
按照表1 制备样品溶液,取水提取液药包材溶出物测定法(通则4204)测定,应符合表2的规定。
2.2 不挥发物
按照表1 制备样品溶液,取有机可提取物溶液按照药包材溶出物测定法(通则4204),应符合表2的规定。
2.3 总有机碳(TOC)
按照表1 制备样品溶液,取水提取物溶液按照药包材溶出物测定法(通则4204),参考制药用水中总有机碳测定法(通则0682)。
2.4 金属离子
基于目前国内已经转化应用ICH Q3D 要求对药品中有害元素进行质量控制的现状通则5400 增加金属离子检查项目,关注金属材料配方及有害元素种类,按照1类、2A类、3类、其他元素分别建立关注及考察元素范围等。关注金属材料配方及工艺中的有害元素种类,元素杂质检查参照ICH Q3D 元素杂质指导原则,为吸入、肠外、皮肤、经皮和口服给药等途径提取元素杂质的安全性评估提供指导,识别已知或潜在元素杂质的来源,结合药品质量要求,对杂质元素进行风险评估。由于用于药品包装用金属组件和容器的配方组成已知,ICH Q3D 元素杂质指导原则为毒理学关注的每个元素建立了允许的每日暴露(PDE),并采用基于风险的方法来控制药品中的元素杂质。
验收标准:按照表1 直接接触药品的药品包装用金属组件和容器溶出物制备模拟选择合适的浸泡介质,参照表3进行元素评估,对可提取元素参照ICH Q3D程序相一致的定量毒理学安全风险评估,酌情使用ICH Q3D PDE值,参照30%的阈值用于确定是否需要控制特定可提取元素的手段。同时参照表3关注材料中的其他类型元素结合药品制剂形式建立评估方法,评估包装材料的影响。
2.5 涂料单体迁移量
对于使用有机涂层涂料的金属组件与包装,需关注涂层涂料单体的迁移(包含但不限于双酚A、对苯二甲酸、丙烯酸、己内酰胺、丁二醇、甲醛等*)按照表1 直接接触药品的药品包装用金属组件和容器溶出物制备,基于剂型的风险程度设立限度指标,应符合品类通则、企业标准或质量协议的规定。
备注*包含不限于上述涂层涂料单体,药包材生产和使用方应该结合使用的涂层涂料类型制定适合的涂层涂料单体标准和指标,并制定相关的协议。
2.6内涂层连续性
对于使用内涂层和镀层的金属容器,依照金属内涂层连续性测定法(通则 4058)检查,测定电流不得过40mA。
2.7 耐腐蚀性能
适用时,对于直接接触药品的金属组件和容器,依照金属耐腐蚀性能测定法(通则4050)检查,应未见明显腐蚀。
3. 其他要求——无菌、微生物限度或生物负载
结合实际情况,根据不同用途及生产使用方式选择相应的无菌、微生物限度或生物负载等进行检查。