为进一步完善化妆品技术标准,中国食品药品检定研究院(以下简称“中检院”)发布关于公开征求《28天重复剂量吸入毒性试验》等意见的通知,涉及7个试验方法,及禁用原料目录更新。
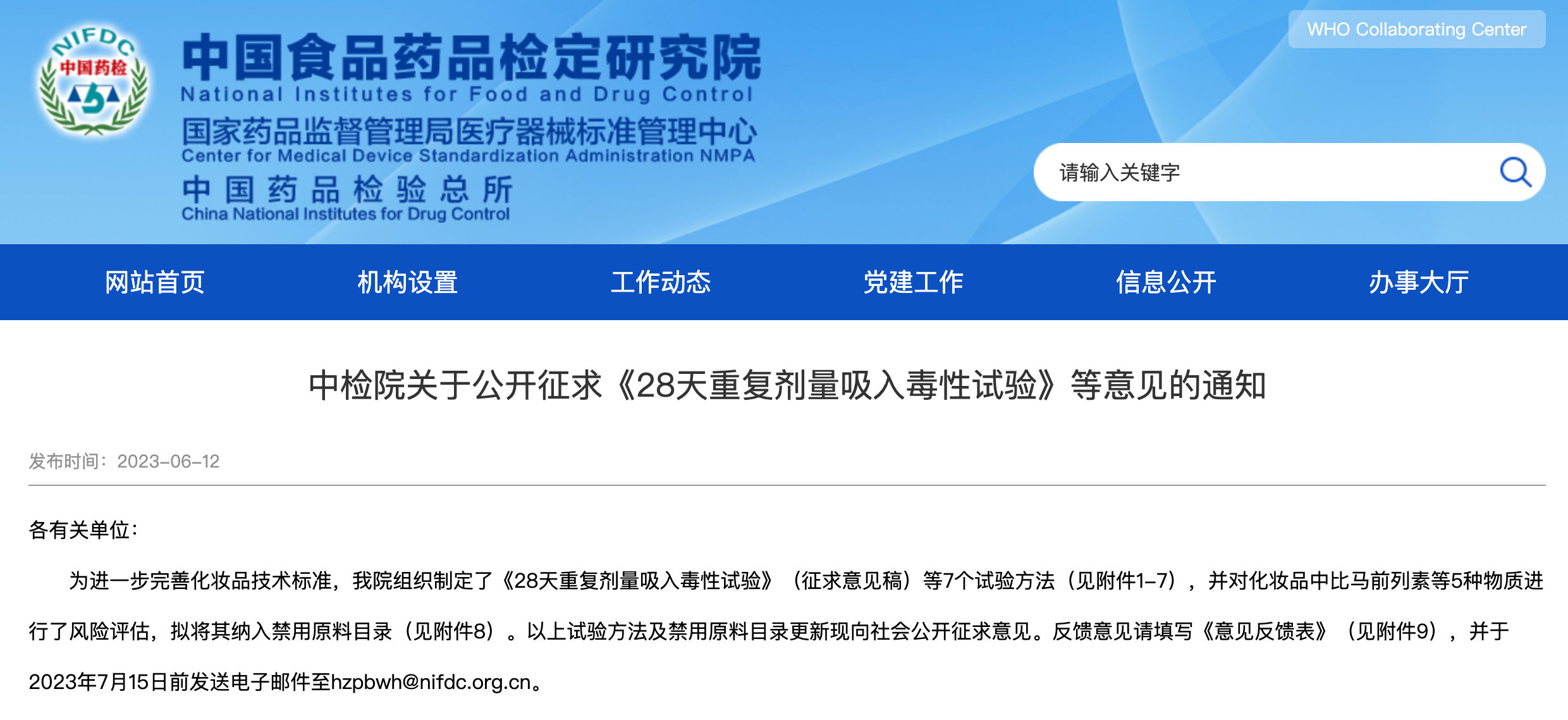
● 化妆品禁用原料目录增补表
● 以下附件可点击原文获取:中检院关于公开征求《28天重复剂量吸入毒性试验》等意见的通知
1.《28天重复剂量吸入毒性试验(征求意见稿)及起草说明》
范围:
本规范规定了啮齿类动物28天重复剂量吸入毒性试验的基本原则、要求和方法
本规范适用于化妆品原料的28天重复剂量吸入毒性的评价。
试验目的:
对于有短期反复吸入暴露可能的化妆品原料,需进行28天重复剂量吸入毒性试验。通过该试验不仅可获得一定时期内反复吸入受试物后引起的健康效应、受试物作用靶器官和受试物体内蓄积能力资料,并可估计吸入的无有害作用水平,后者可用于人群吸入的定量风险评估。
2.《90天重复剂量吸入毒性试验(征求意见稿)及起草说明》
范围:
本规范规定了啮齿类动物90天重复剂量吸入毒性试验的基本原则、要求和方法。
本规范适用于化妆品原料的90天重复剂量吸入毒性的评价。
试验目的:
对于有长期反复吸入暴露可能的化妆品原料,需进行90天重复剂量吸入毒性试验。通过该试验不仅可获得一定时期内反复吸入受试物后引起的健康效应、受试物作用靶器官和受试物体内蓄积能力资料,并可估计吸入的无有害作用水平,后者可用于人群吸入的定量风险评估。
3.《扩展一代生殖发育毒性试验(征求意见稿)及起草说明》
范围:
本规范规定了扩展一代生殖发育毒性试验基本原则,试验方法和技术要求。
本规范用于检测化妆品原料的生殖发育毒性。
试验目的:
提供关于受试物产前、产后暴露对雌性、雄性动物生殖功能、生育力及子代发育影响的确切信息。
4.《两代生殖发育毒性试验(征求意见稿)及起草说明》
范围:
本规范规定了两代生殖发育毒性试验基本原则,试验方法和技术要求。
本规范用于检测化妆品原料的生殖发育毒性。
试验目的:
提供关于受试物产前、产后暴露对雌性、雄性动物生殖功能、生育力及子代发育影响的确切信息。
5.《皮肤吸收体内试验方法(征求意见稿)及起草说明》
范围:
本方法规定了皮肤吸收体内试验方法的术语和定义、试验原则、试验方法、试验数据和报告。
本方法适用于化妆品原料经皮吸收的体内试验。
试验目的:
本方法阐述了化妆品原料经皮吸收的体内试验方法,以便为化妆品原料的毒性分级、标签标识和应用提供试验依据。本试验方法适用于单一成分的化妆品原料,非单一成分的原料若使用本方法进行评价,需要提供更多的科学依据说明其可行性。
6.《急性吸入毒性试验 急性毒性分级法(征求意见稿)及起草说明》
范围:
本试验方法规定了急性吸入毒性试验 急性毒性分级法的试验原则、试验方法、数据和报告。
本试验方法适用于化妆品原料急性吸入毒性的急性毒性分级。
试验目的:
本试验方法的目的是通过测试获得受试物的健康危害信息等资料,从而可参考联合国全球化学品分级和标签管理协调制度(the United Nations(UN)Globally Harmonized System (GHS)of Classification and Labelling of Chemicals)的化学品急性吸入毒性分级标准对其急性毒性进行分级。本试验方法适用于单一成分的化妆品原料,非单一成分的原料若使用本方法进行评价,需要提供更多的科学依据说明其可行性。本试验方法不适用于测试难溶的同分异构物、纤维类、纳米类原料等。
7.《体外皮肤变态反应 U937细胞激活试验(征求意见稿)及起草说明》
范围:
本方法规定了体外皮肤变态反应 U937细胞激活试验的基本原则、要求和方法。
本方法适用于化妆品用化学原料潜在致敏性的评价。
试验目的:
本试验用于检测体外培养的人组织细胞淋巴瘤细胞表面标记物CD86的表达,以评价受试物引起皮肤变态反应的可能性。
8.《化妆品禁用原料目录增补表》
9.《意见反馈表》