
2023年05月26日,据欧盟食品安全局(EFSA)消息,欧盟营养、新型食品和食物过敏源(NDA)研究小组(以下简称“该小组”)就裸藻多糖(paramylon)作为新型食品(Novel Food)的安全性发表科学意见。
裸藻多糖(paramylon)(以下简称”该NF”)是从单细胞微藻-纤细裸藻(Euglena gracilis)中分离的一种线性、无支链的β-1,3-D-葡聚糖聚合物。
NF的来源E. gracilis,在中国、日本和美国有作为食品(食品成分和食品补充剂)使用的历史。2020年,干燥的E. gracilis被授权在欧盟市场上销售。授权用途包括作为食品补充剂和作为食品配料添加到一些食品中。
在美国,该NF自2019年起作为食品补充剂和食品配料上市。2021年,巴西卫生监管局(ANVISA)授权将该NF投放到市场。
2.NF的生产工艺
该NF由E. gracilis进行发酵后,经过分离,纯化,干燥等加工步骤后获得。
在2019年,E. gracilis已被推荐到QPS列表中,用途为“仅用于生产目的”,包括基于微藻生物质的食品产品。该NF生产过程中,E. gracilis会经生产加工过程灭活。
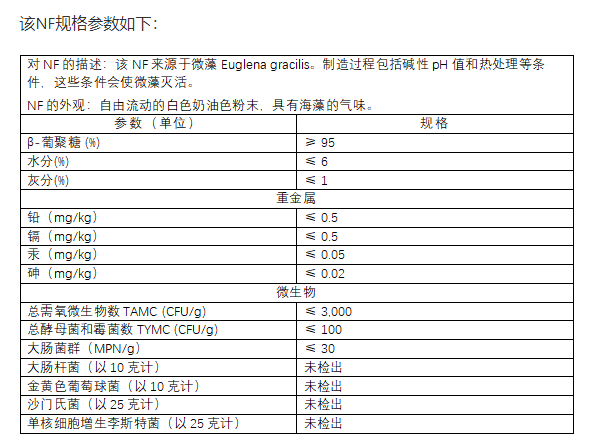
3.NF的组成和规格
申请人提供了五批该NF成分组成的分析数据,显示该NF由至少95%的膳食纤维(β-葡聚糖)和少量的蛋白质、脂肪、灰分和水分组成。
4.NF的拟定使用条件
申请人建议将该NF用作食品补充剂(food supplements),用于添加到多种普通食品中的成分,以及用于体重控制代餐食品。
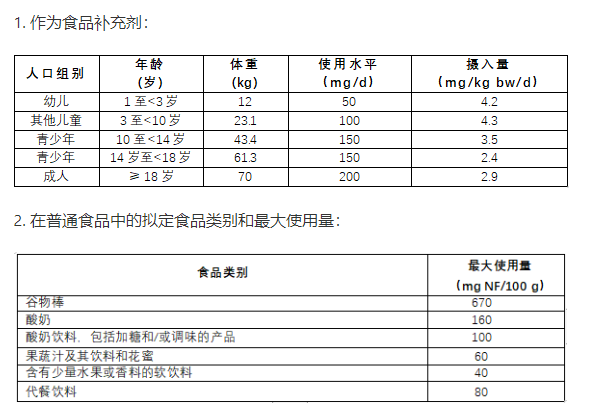
3.用于控制体重代餐食品时:
建议最大使用量为600 mg NF/d,拟定目标人群是成年人。
5.NF的相关测试与分析
重金属,微生物和污染物
申请人提供了五批该NF的重金属(铅,镉,汞,砷)和微生物(需氧微生物,大肠菌群,酵母菌和霉菌,大肠杆菌,金黄色葡萄球菌,沙门氏菌,单核细胞增生李斯特菌)检测数据。
申请人还提供了五批NF的多环芳烃(PAHs)和黄曲霉毒素B1、B2、G1和G2的分析报告,前者低于检测限(<0.3 μg/kg),后者也都低于检测限(<0.3 μg/kg)。
该小组认为,申请人所提供的有关成分的信息是充分的,不会引起安全问题。
稳定性
申请人提交了两项加速稳定性研究(40°C,75%的相对湿度(RH)下)和一项环境条件下(25°C和60%RH)的长期(4年)稳定性研究。此外,还在通常环境条件下(25℃,60%相对湿度),将NF配制成胶囊(与微晶纤维素混合),评估其稳定性,测试时间长达24个月。最后,申请人同样对该NF在各种pH值下的稳定性进行了测试。
该小组认为,这些数据充分提供了该NF稳定性的相关信息。
吸收、分布、代谢和排泄(ADME)
申请人没有提交关于该NF的ADME研究。申请人表示,该NF由至少95%的不溶性β-葡聚糖组成,可不经消化通过人类胃肠道,因此,不需要进行具体的ADME研究。
该小组认同申请人给出的解释。
营养信息
该NF至少由95%的β-1,3-葡聚糖组成。申请人提供了对NF中近似物和一些矿物质的分析,其浓度没有引起安全问题
该小组认为,考虑到该NF的构成和拟定的使用条件,食用该NF在营养方面无不利影响。
毒理学
申请人提供了该NF的四项毒理学研究,分别为体内微核试验、14天经口毒性/适口性研究和两项90天经口毒性研究。此外,申请人还提交了纤细裸藻干物质(含58.8% β-葡聚糖)的一项急性经口毒性研究和两项遗传毒性研究。
提交的毒性研究中,该NF没有引发安全问题。
人体研究
申请人没有提供此方面的内容。
过敏性
根据申请人所提供的批次测试,NF含有蛋白质的浓度为0.4-1.1%。
申请人进行了全面的文献检索,没有发现任何研究或案例报告表明NF的潜在过敏性。此外,该NF的来源,即E. gracilis,在中国、日本和美国都有使用历史,没有发现过敏性反应的报告。
该小组认为,一般人群对该NF的过敏反应风险未知,但预计会很低。
6.该小组对该NF的评估结论
经过评估,该小组得出结论,在拟定的使用条件下,裸藻多糖(paramylon)作为新型食品是安全的。